الروابط الكيميائية
صفحة 1 من اصل 1
 الروابط الكيميائية
الروابط الكيميائية
درس الروابط الكيميائية ( التناسقية ، الهيدروجينية ، الفلزية وقوى فان درفال )
3- يمثّل للرابطة التساهمية التناسقية .
4- يوضّح مفهوم الرابطة الهيدروجينية .
5- يمثّل للرابطة الهيدروجينية .
6- يوضح أثر الرابطة الهيدروجينية على درجات غليان وانصهار المواد .
7- يعلّل ارتفاع درجة غليان الماء مقارنةً بمركبات عناصر المجموعة السادسة مع الهيدروجين .
8- يشرح مفهوم الرابطة الفلزية .
9- يفسّر سبب توصيل الفلزات الجيد للحرارة والكهرباء .
10- يذكر ماهية روابط ( قوى ) فان درفال .
11- يمثّل لروابط فان درفال .
الرابطة التناسقية CO-ORDINATE (DATIVE COVALENT) BONDING
عبارة عن رابطة تساهمية تساهم فيها إحدى الذرتين بالزوج الالكتروني الرابط بينما يقتصر دور الذرة الأخرى على المساهمة بمجال فارغ .
مثال1 : في تفاعل النشادر مع كلوريد الهيدروجين لانتاج ملح كلوريد الأمونيوم تتكون رابطة تناسقية بين ذرة النيتروجين في النشادر وذرة الهيدروجين في كلوريد الهيدروجين .
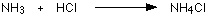
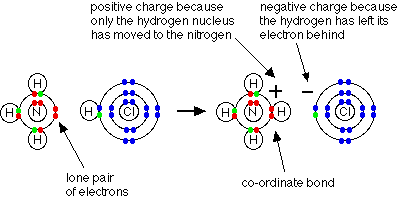 فالرابطة التناسقية تتكون بين ( ذرة مانحة ) تتكون عليها شحنة موجبة و ( ذرة مستقبلة ) تتكون عليها شحنة سالبة ويشار إلى الرابطة التناسقية عادةً بسهم يتجه من الذرة المانحة إلى الذرة المستقبلة .
فالرابطة التناسقية تتكون بين ( ذرة مانحة ) تتكون عليها شحنة موجبة و ( ذرة مستقبلة ) تتكون عليها شحنة سالبة ويشار إلى الرابطة التناسقية عادةً بسهم يتجه من الذرة المانحة إلى الذرة المستقبلة .
وحقيقة ما حدث في التفاعل السابق هو ارتباط جزيء النشادر بالبروتون ليتكون أيون الأمونيوم .
 مثال2 : عند إذابة غاز كلوريد الهيدروجين في الماء لتكوين حمض الكلور تتكون رابطة تناسقية بين ذرة الأكسجين في الماء وذرة الهيدروجين في كلوريد الهيدروجين .
مثال2 : عند إذابة غاز كلوريد الهيدروجين في الماء لتكوين حمض الكلور تتكون رابطة تناسقية بين ذرة الأكسجين في الماء وذرة الهيدروجين في كلوريد الهيدروجين .


وهنا تكون ذرة الأكسجين هي الذرة المانحة وذرة الهيدروجين الذرة المستقبلة .
مثال 3 : في تفاعل النشادر مع ثالث فلوريد البورون تتكون رابطة تناسقية بين ذرة النيتروجين ( المانحة ) وذرة البورون ( المستقبلة ).

 وتسمى المركبات الحاوية للراوبط التناسقية بالمركبات التناسقية ، والجدير بالذكر أن معظم العناصر الانتقالية ترتبط بروابط تناسقية وتكوّن هذا النوع من المركبات .
وتسمى المركبات الحاوية للراوبط التناسقية بالمركبات التناسقية ، والجدير بالذكر أن معظم العناصر الانتقالية ترتبط بروابط تناسقية وتكوّن هذا النوع من المركبات .
وكما يتضح من المثال فإن الرابطة الهيدروجينية تربط الجزء السالب ( ذرة ذات سالبية كهربية عالية ) في جزيء المادة بالطرف الموجب ( ذرة هيدروجين ) في جزيء أخر .  كما أن للروابط الهيدروجينية التي تربط بين جزيئات الماء تأثير مباشر في القيمة العليا للكثافة التي يتخذها الماء والتي تساوي 1 جم / سم مكعب عند 4 درجة مئوي بينما تكون كثافة الماء أقل من ( 1جم/سم مكعب ) عند أعلى وأقل من ( 4 درجة م ) وهذا ما يجعل الجليد يطفوا على سطح التجمعات المائية عند تجمد الماء . وأيضاً ترجع خاصية التوتر السطحي المميزة في الماء إلى ارتباط جزيئات الماء بروابط هيدروجينية . وفيما يلي مقارنة بين الماء والميثان من حيث درجة الغليان ودرجة الانصهار :
كما أن للروابط الهيدروجينية التي تربط بين جزيئات الماء تأثير مباشر في القيمة العليا للكثافة التي يتخذها الماء والتي تساوي 1 جم / سم مكعب عند 4 درجة مئوي بينما تكون كثافة الماء أقل من ( 1جم/سم مكعب ) عند أعلى وأقل من ( 4 درجة م ) وهذا ما يجعل الجليد يطفوا على سطح التجمعات المائية عند تجمد الماء . وأيضاً ترجع خاصية التوتر السطحي المميزة في الماء إلى ارتباط جزيئات الماء بروابط هيدروجينية . وفيما يلي مقارنة بين الماء والميثان من حيث درجة الغليان ودرجة الانصهار :
Melting point /°C
Boiling point /°C
CH4
16 Relative molecular mass
-182 Melting point /°C
-164 Boiling point /°C
H2O
18 Relative molecular mass
0 Melting point /°C
100 Boiling point /°C
Relative molecular massيلاحظ الفرق الكبير في درجة الغليان والانصهار بين المركبين فالماء درجة غليانه وانصهاره أعلى بكثير من درجة غليان وانصهار الميثان بالرغم من تقارب الوزن الجزيئي لهما . وبالطبع فإن السبب يرجع إلى قوة الروابط الهيدروجينية الموجودة في الماء .
الرابطة الفلزية ( ****LLIC BONDING )
جميع الفلزات ( ماعدا الزئبق ) توجد في الحالة العنصرية في الحالة الصلبة ولعل سبب ذلك هو تلك الروابط القوية التي تربط بين ذرات الفلز ( المعدن ) فيمكن النظر إلى الفلز في الحالة الصلبة كبحرٍ من الشحنات الموجبة ( الأنوية ) تتحرك بينها الالكترونات بحرية وتنتقل من ذرة إلى أخرى .
ومن المعروف أن قوة هذه الروابط تعتمد على عاملين ...
الأول : عدد الالكترونات فكلما كان عدد الالكترونات في الجسيمات ( ذرات أو جزيئات ) أكثر كانت الرابطة أقوى وهذا ما يفسر ازدياد درجات غليان الهالوجينات كلما نزلنا إلى أسفل في عناصر المجموعة السابعة ( أ ) .
والثاني : المسافة بين الجسيمات _ وهذا ما أشار إليه الأخ RDX _ فكلما زادت هذه المسافة ضعفت الرابطة ولهذا نجد أن قوى فان ديرفال تزداد قوةً بزيادة الضغط لأن الجسيمات تكون متلاصقة أكثر بزيادة الضغط كما وأنها تضعف بارتفاع درجة الحرارة لأن الجسيمات تبتعد أكثر بارتفاع درجة الحرارة .
وعليه فإننا _ من وجهة نظري _ يمكن أن نخلص إلى النتيجة التالية : وهي أن روابط فان ديرفال تربط بين جسيمات المادة الواحدة غالباً ويكون من الصعب تكوّن هذه الروابط بين مادتين منفصلتين ومختلفتين كما هو الحال في مثال الماصة والكتاب ولكبر المسافة بينهما ( المقصود بالمسافة هنا المسافة على المستوى الذري او الجزيئي وليست المسافة المحسوسة والمنظورة ) وبعد الجسيمات عن بعضها البعض .
ولو افترضنا تكون هذه الروابط بين الماصة والكتاب فإنه نظراً لضعفها فلا يمكن لنا أن ندركها أو نلاحظها .
[/b][/size][/center]
الموضوع : درس الروابط الكيميائية ( التناسقية ، الهيدروجينية ، الفلزية وقوى فان درفال ) .
الأهداف التعليمية
يتوقع من الطالب في نهاية الدرس أن :
1- يعرّف الرابطة التساهمية التناسقية . 2- يميّز بين الرابطة التساهمية العادية والرابطة التساهمية التناسقيةالأهداف التعليمية
يتوقع من الطالب في نهاية الدرس أن :
3- يمثّل للرابطة التساهمية التناسقية .
4- يوضّح مفهوم الرابطة الهيدروجينية .
5- يمثّل للرابطة الهيدروجينية .
6- يوضح أثر الرابطة الهيدروجينية على درجات غليان وانصهار المواد .
7- يعلّل ارتفاع درجة غليان الماء مقارنةً بمركبات عناصر المجموعة السادسة مع الهيدروجين .
8- يشرح مفهوم الرابطة الفلزية .
9- يفسّر سبب توصيل الفلزات الجيد للحرارة والكهرباء .
10- يذكر ماهية روابط ( قوى ) فان درفال .
11- يمثّل لروابط فان درفال .
الرابطة التناسقية CO-ORDINATE (DATIVE COVALENT) BONDING
عبارة عن رابطة تساهمية تساهم فيها إحدى الذرتين بالزوج الالكتروني الرابط بينما يقتصر دور الذرة الأخرى على المساهمة بمجال فارغ .
مثال1 : في تفاعل النشادر مع كلوريد الهيدروجين لانتاج ملح كلوريد الأمونيوم تتكون رابطة تناسقية بين ذرة النيتروجين في النشادر وذرة الهيدروجين في كلوريد الهيدروجين .
وحقيقة ما حدث في التفاعل السابق هو ارتباط جزيء النشادر بالبروتون ليتكون أيون الأمونيوم .

وهنا تكون ذرة الأكسجين هي الذرة المانحة وذرة الهيدروجين الذرة المستقبلة .
مثال 3 : في تفاعل النشادر مع ثالث فلوريد البورون تتكون رابطة تناسقية بين ذرة النيتروجين ( المانحة ) وذرة البورون ( المستقبلة ).
الرابطة الهيدروجينية
عبارة عن تجاذب كهربي ضعيف بين جزيئات المركب التساهمي القطبي المحتوي على ذرة هيدروجين . فلاش يوضح الرابطة الهيدروجينية في الثلج
أثر الرابطة الهيدروجينية على خواص المادة
تؤثر الروابط الهيدروجينية على الخواص الطبيعية للمادة ، فدرجات غليان وانصهار المواد المحتوية على روابط هيدروجينية أعلى من درجات غليان وانصهار مثيلاتها من المواد ويبرز هذا الأثر بشكلٍ واضح في خواص الماء ،فللماء صفات خاصة ترجع إلى الروابط الهيدروجينية المميزة التي تربط بين جزيئاته ، فدرجة غليان الماء ( 100 درجة م ) مرتفعة جداً إذا ما قورنت بدرجات غليان مركبات عناصر المجموعة السادسة مع الهيدروجين بالرغم من أن الوزن الجزيء للماء أقل من الوزن الجزيء لهذه المركبات . Melting point /°C
Boiling point /°C
CH4
16 Relative molecular mass
-182 Melting point /°C
-164 Boiling point /°C
H2O
18 Relative molecular mass
0 Melting point /°C
100 Boiling point /°C
Relative molecular mass
الرابطة الفلزية ( ****LLIC BONDING )
جميع الفلزات ( ماعدا الزئبق ) توجد في الحالة العنصرية في الحالة الصلبة ولعل سبب ذلك هو تلك الروابط القوية التي تربط بين ذرات الفلز ( المعدن ) فيمكن النظر إلى الفلز في الحالة الصلبة كبحرٍ من الشحنات الموجبة ( الأنوية ) تتحرك بينها الالكترونات بحرية وتنتقل من ذرة إلى أخرى .
[size=16][b]
روابط ( قوى ) فان درفال
ترتبط جزيئات المركبات التساهمية غير القطبية بعضها ببعض بروابط فيزيائية ضعيفة جداً ناتجة من تجاذب أنوية الذرات في جزيء معين مع الكترونات التكافؤ في جزيء مجاور ، يطلق على هذه القوى روابط فان درفال .
ومثال ذلك ترتبط جزيئات الهالوجينات في حالتها العنصرية بروابط فان درفال ونجد أنه بنزولنا إلى أسفل في المجموعة ( من الفلور إلى اليود ) تزداد قوة روابط فان درفال بسبب ازدياد العدد الذري ( عدد البروتونات في الأنوية وعدد الالكترونات في مستويات الطاقة الالكترونية ) لذلك نجد أنه كلما نزلنا إلى أسفل في المجموعة تزداد كثافة الهالوجين كما تزداد درجة غليانه وانصهاره . ( الحقيقة هناك عامل أخر يسبب هذه الزيادة وهو ازدياد الوزن الجزيئي بنزولنا إلى أسفل في مجموعة الهالوجينات ) فبينما نجد الفلور غاز خفيف نجد الكلور غاز أثقل منه والبروم سائل واليود مادة صلبة .
روابط ( قوى ) فان درفال
ترتبط جزيئات المركبات التساهمية غير القطبية بعضها ببعض بروابط فيزيائية ضعيفة جداً ناتجة من تجاذب أنوية الذرات في جزيء معين مع الكترونات التكافؤ في جزيء مجاور ، يطلق على هذه القوى روابط فان درفال .
ومثال ذلك ترتبط جزيئات الهالوجينات في حالتها العنصرية بروابط فان درفال ونجد أنه بنزولنا إلى أسفل في المجموعة ( من الفلور إلى اليود ) تزداد قوة روابط فان درفال بسبب ازدياد العدد الذري ( عدد البروتونات في الأنوية وعدد الالكترونات في مستويات الطاقة الالكترونية ) لذلك نجد أنه كلما نزلنا إلى أسفل في المجموعة تزداد كثافة الهالوجين كما تزداد درجة غليانه وانصهاره . ( الحقيقة هناك عامل أخر يسبب هذه الزيادة وهو ازدياد الوزن الجزيئي بنزولنا إلى أسفل في مجموعة الهالوجينات ) فبينما نجد الفلور غاز خفيف نجد الكلور غاز أثقل منه والبروم سائل واليود مادة صلبة .
عندما تدور الالكترونات عشوائيا حول النواه فانها تتركز احيانا في منطقة معينة وبالتالي تكون للذرة شحنة سالبة مؤقته في تلك المنطقة ... وفي الاتجاه المعاكس تكون الشحنة موجبة . من هنا تحدث عملية تجاذب بين الطرف الموجب المؤقت في المركب الاول والطرف السالب المؤقت في المركب والثاني والعكس صحيح. وقوة الترابط هذه تسمى قوى فان ديرفال
ولان موقع رابطة فان ريرفال غير ثابت فهو متذبذب حسب حركة الالكترونات تكون هذه الرابطة ضعيفة جدا .
****
قوى فانديرفال عبارة عن قوى كهربية ( تجاذب كهربي ) فهي في طبيعتها كالرابطة الأيونية وكالرابطة الهيدروجينية ولكنه تجاذب كهربي ضعيف للغاية ناتج وكما ذكرت الأستاذة لافندر من الأقطاب اللحظية المؤقتة (Temporary fluctuating dipoles) التي تنشأ في الجسيمات المتعادلة نتيجة حركة الالكترونات وتركزها في جزء معين من الجسيم .

الجسيم المتعادل الشحنة قبل تكوّن الأقطاب

الجسيم المتعادل بعد اكتسابه الشحنات المؤقتة
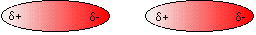
رابطة فان ديرفال بين جسيمين

روابط فان ديرفال بين الجسيمات
ولان موقع رابطة فان ريرفال غير ثابت فهو متذبذب حسب حركة الالكترونات تكون هذه الرابطة ضعيفة جدا .
****
قوى فانديرفال عبارة عن قوى كهربية ( تجاذب كهربي ) فهي في طبيعتها كالرابطة الأيونية وكالرابطة الهيدروجينية ولكنه تجاذب كهربي ضعيف للغاية ناتج وكما ذكرت الأستاذة لافندر من الأقطاب اللحظية المؤقتة (Temporary fluctuating dipoles) التي تنشأ في الجسيمات المتعادلة نتيجة حركة الالكترونات وتركزها في جزء معين من الجسيم .
الجسيم المتعادل الشحنة قبل تكوّن الأقطاب
الجسيم المتعادل بعد اكتسابه الشحنات المؤقتة
رابطة فان ديرفال بين جسيمين
روابط فان ديرفال بين الجسيمات
ومن المعروف أن قوة هذه الروابط تعتمد على عاملين ...
الأول : عدد الالكترونات فكلما كان عدد الالكترونات في الجسيمات ( ذرات أو جزيئات ) أكثر كانت الرابطة أقوى وهذا ما يفسر ازدياد درجات غليان الهالوجينات كلما نزلنا إلى أسفل في عناصر المجموعة السابعة ( أ ) .
والثاني : المسافة بين الجسيمات _ وهذا ما أشار إليه الأخ RDX _ فكلما زادت هذه المسافة ضعفت الرابطة ولهذا نجد أن قوى فان ديرفال تزداد قوةً بزيادة الضغط لأن الجسيمات تكون متلاصقة أكثر بزيادة الضغط كما وأنها تضعف بارتفاع درجة الحرارة لأن الجسيمات تبتعد أكثر بارتفاع درجة الحرارة .
وعليه فإننا _ من وجهة نظري _ يمكن أن نخلص إلى النتيجة التالية : وهي أن روابط فان ديرفال تربط بين جسيمات المادة الواحدة غالباً ويكون من الصعب تكوّن هذه الروابط بين مادتين منفصلتين ومختلفتين كما هو الحال في مثال الماصة والكتاب ولكبر المسافة بينهما ( المقصود بالمسافة هنا المسافة على المستوى الذري او الجزيئي وليست المسافة المحسوسة والمنظورة ) وبعد الجسيمات عن بعضها البعض .
ولو افترضنا تكون هذه الروابط بين الماصة والكتاب فإنه نظراً لضعفها فلا يمكن لنا أن ندركها أو نلاحظها .
[/b][/size][/center]
صفحة 1 من اصل 1
صلاحيات هذا المنتدى:
لاتستطيع الرد على المواضيع في هذا المنتدى